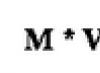Существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
Кристаллическая решётка вещества - это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства. В различных решетках различают межузловое пространство и непосредственно узлы - точки, в которых расположены сами частицы.
Кристаллическая решётка бывает четырех типов: металлическая, молекулярная, атомная, ионная. Типы решеток определяются в соответствии с видом частиц, расположенных в их узлах, а также характером связей между ними.
Кристаллическая решётка называется молекулярной в том случае, если в ее узлах располагаются молекулы. Они связаны между собой межмолекулярными сравнительно слабыми силами, называемые ван-дер-ваальсовыми, однако сами атомы внутри молекулы соединяются существенно более сильной либо неполярной). Молекулярная кристаллическая решетка свойственна хлору, твердому водороду, и другим веществам, являющимся газообразными при обычной температуре.
Кристаллы, которые образуют благородные газы, также имеют молекулярные решетки, состоящие из одноатомных молекул. Большинство твердых органических веществ имеют именно такую структуру. Число же которым свойственна молекулярная структура, весьма невелико. Это, например, твердые галогеноводороды, природная сера, лед, твердые простые вещества и некоторые другие.
При нагревании относительно слабые межмолекулярные связи разрушаются довольно легко, поэтому вещества с такими решетками имеют очень низкие температуры плавления и малую твердость, они нерастворимы либо малорастворимы в воде, растворы их практически не проводят электрический ток, характеризуются значительной летучестью. Минимальные температуры кипения и плавления - у веществ из неполярных молекул.
Металлической называется такая кристаллическая решетка, узлы которой сформированы атомами и положительными ионами (катионами) металла со свободными валентными электронами (отцепившимися от атомов при образовании ионов), беспорядочно движущимися в объеме кристалла. Однако эти электроны по существу являются полусвободными, так как могут беспрепятственно перемещаться только в рамках, которые ограничивает данная кристаллическая решетка.
Электростатические электроны и положительные ионы металлов взаимно притягиваются, чем объясняется стабильность металлической кристаллической решетки. Совокупность свободных движущихся электронов называют электронным газом - он обеспечивает хорошую электро- и При появлении электрического напряжения электроны устремляются к положительной частице, участвуя в создании электрического тока и взаимодействуя с ионами.
Металлическая кристаллическая решетка характерна, главным образом, для элементарных металлов, а также для соединений различных металлов друг с другом. Основные свойства, которые присущи металлическим кристаллам(механическая прочность, летучесть, достаточно сильно колеблются. Однако такие физические свойства, как пластичность, ковкость, высокая электро- и теплопроводность, характерный металлический блеск свойственны лишь исключительно кристаллам с металлической решеткой.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллыЖидкие кристаллы открыты в конце XIX века, но изучены впоследние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водянойлёдплавится при температуре выше 200 0 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решётокЛюбое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку .
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p , t ,…)существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
|
ионная |
металлическая |
|||
|
Что в узлах кристаллической решётки, структурная единица |
ионы |
атомы |
молекулы |
атомы и катионы |
|
Тип химической связи между частицами узла |
ионная |
ковалентная: полярная и неполярная |
металлическая |
|
|
Силы взаимодействия между частицами кристалла |
электростати- ческие |
ковалентные |
межмолекуляр- ные |
электростати- ческие |
|
Физические свойства, обусловленные кристаллической решёткой |
· силы притяжения между ионами велики, · Т пл. (тугоплавкте), · легко растворяются в воде, · расплав и р-р проводит эл.ток, · нелетучи (не имеют запаха) |
· ковалентные связи между атомами велики, · Т пл. и T кип очень, · в воде не растворяются, · расплав не проводит эл.ток |
· силы притяжения между молекулами невелики, · Т пл. ↓, · некоторые растворяются в воде, · обладают запахом – летучи |
· силы взаимодействия велики, · Т пл. , · Высокие тепло и электропроводность |
|
Агрегатное состояние вещества при обычных условиях |
твёрдое |
твёрдое |
твёрдое, газообразное, жидкое |
твёрдое, жидкое(Нg) |
|
Примеры |
большинство солей, щелочей, оксиды типичных металлов |
С (алмаз, графит), Si , Ge , B , SiO 2 , CaC 2 , SiC (карборунд), BN , Fe 3 C , TaC (t пл. =3800 0 С) Красный и чёрный фосфор. Оксиды некоторых металлов. |
все газы, жидкости, большинство неметаллов: инертные газы, галогены, H 2 , N 2 , O 2 , O 3 , P 4 (белый), S 8 . Водородные соединения неметаллов, оксиды неметаллов: H 2 O , CO 2 «сухой лёд». Большинство органических соединений. |
Металлы, сплавы |
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
- Взаимосвязь между положениемэлемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
|
группа |
|||||||||
|
III |
VII |
VIII |
|||||||
|
п е р и о д |
H 2 |
||||||||
|
N 2 |
O 2 |
F 2 |
|||||||
|
III |
P 4 |
S 8 |
Cl 2 |
||||||
|
Br 2 |
|||||||||
|
I 2 |
|||||||||
|
Тип кристаллическойрешётки |
металлическая |
атомная |
молекулярная |
||||||
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (CH 3 COOH ), сахар (C 12 H 22 O 11), калийное удобрение (KCl ), речной песок (SiO 2) – температура плавления 1710 0 C , аммиак (NH 3), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
- По формулам приведённых веществ: SiC
, CS
2 , NaBr
, C
2 H
2 - определите тип кристаллической решётки
(ионная, молекулярная) каждого соединения и на основе этого опишите физические
свойства каждого из четырёх веществ.
- Тренажёр №1. "Кристаллические решётки"
- Тренажёр №2. "Тестовые задания"
- Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a ). тугоплавки и хорошо растворимы в водеб). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
2) Понятия «молекула»не применимо по отношению к структурной единице вещества:
a
).
вода
б). кислород
в). алмаз
г). озон
3) Атомная кристаллическая решётка характерна для:
a
).
алюминияи графита
б). серы и йода
в).
оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления,электропроводно, то его кристаллическая решётка:
а).
молекулярная
б). атомная
в). ионная
г). металлическая
Химия - удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е - плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру - лёд.
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Определение
 Кристаллическая решётка - особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы - места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Кристаллическая решётка - особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы - места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества , в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными - они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Атомный тип
В этом типе в узлах расположены атомы того или иного вещества, которые связаны ковалентными связями. Этот вид связи образован парой электронов двух соседних атомов. Благодаря этому они связываются равномерно и в строгом порядке.
Вещества с атомной кристаллической решёткой характеризуются следующими свойствами: прочность и большая температура плавления. Такой тип связи представлен у алмаза, кремния и бора .
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования , конкретные примеры.
Молекулярный тип
В узлах такого типа находятся ионы, связанные между собой ван-дер-ваальсовыми силами. Благодаря слабым межмолекулярным связям такие вещества, например, лёд, двуокись углерода и парафин, характеризуются пластичностью, электро- и теплопроводностью.
Металлический тип
 В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы . Электроны, которые находятся в межузловом
пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы . Электроны, которые находятся в межузловом
пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями . Ранее мы уже рассматривали а. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично , больше взаимодействуют между собой , совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно , и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другиеположения, то мы имеем дело с твердым веществом .

Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода . При нормальных условиях она жидкая , при 0 о С она замерзает – переходит из жидкого состояния в твердое , и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму , а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел , в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

– это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц . Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы . По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично , либо более упорядоченн о. Если частицы твердого вещества расположены в пространстве хаотично , вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло .

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями . Соответственно, такая кристаллическая решетка будет очень прочной , разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др .). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет . Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками . Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристалалах: .
В узлах кристалла с атомной кристаллической структурой расположены атомы .
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества .
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые вещества с высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO 2 ; карбид кремния (корунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы . Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса , водродные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить . Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные . Чем больше сила притяжения между молекулами, тем выше температура плавления вещества . Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей . Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О 2 , азот N 2 , вода H 2 O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло .

Связь между частицами в молекулярных кристалалах: межмолекулярные , электростатические или межмолекулярные силы притяжения .
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы .
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества .
Вещества , образующие в твердом состоянии молекулярные кристаллы :
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O 2 , N 2 , H 2 , S 8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H 2 O, оксид серы SO 3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.) ;
- Большинство органических веществ, в которых нет ионных связей — метан CH 4 , бензол С 6 Н 6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы , мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими . В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью . Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO 3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов .

Связь между частицами в ионных кристаллах: .
В узлах кристалла с ионной решеткой расположены ионы .
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества .
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH 4 Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой , которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами ; эти электроны хаотично перемещаются в кристалле ; часть электронов притягивается к ионам . Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют «электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло . Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью , т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : .
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы .
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы .
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества . Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами . Для молекулярной решетки это, например, углекислый газ , для атомной кристаллической решетки — алмаз , для металлической — медь , и для ионной кристаллической решетки — поваренная соль , хлорид натрия NaCl.

Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).

Итоговая таблица связи свойств веществ со строением:

С древнейших времен металлы играют огромную роль в развитии человечества. Внедрение их в повседневную жизнь произвело настоящую революцию как в способах обработки материалов, так и в восприятии человеком окружающей действительности. Современная промышленность и сельское хозяйство, транспорт и инфраструктура невозможны без применения металлов, использования их полезных качеств и свойств. Эти качества, в свою очередь, определяются внутренней структурой данного класса химических соединений, в основе которой лежит кристаллическая решетка.
Понятие и сущность кристаллической решетки
С точки зрения внутреннего устройства любое вещество может находиться в одном из трех состояний - жидком, газообразном и твердом. При этом именно последнее характеризуется наибольшей устойчивостью, что обусловлено тем, что кристаллическая решетка подразумевает не только четкое расположение атомов или молекул в строго определенных местах, но и необходимость приложения достаточно большой силы, чтобы связи между этими элементарными частицами разорвать.
Особенности ионной решетки
Структура любого вещества, находящегося в твердом состоянии, обязательно предполагает периодическую повторяемость молекул и атомов сразу в трех измерениях. При этом в зависимости от того, что находится в узловых пунктах, кристаллическая решетка может быть ионной, атомной, молекулярной и металлической. Что касается первой разновидности, то здесь базовыми компонентами служат разнополярно заряженные ионы, между которыми возникают и действуют так называемые кулоновские силы. При этом сила взаимодействия находится в прямой зависимости от радиусов заряженных частиц.

Такая решетка представляет собой сложную систему, состоящую из катионов металла, в пространстве между которыми перемещаются отрицательно заряженные электроны. Именно наличие этих элементарных частиц придает решетке устойчивость и твердость, ибо они служат своеобразными компенсаторами для положительно заряженных катионов.
Сила и слабость атомной решетки

Достаточно интересной с точки зрения строения является атомная кристаллическая решетка. Уже из названия можно сделать вывод, что в ее узлах располагаются атомы, удерживающиеся за счет ковалентных связей. Многие ученые в последние годы относят данный тип взаимодействия к семейству неорганических полимеров, так как строение данной молекулы во многом определяется валентностью входящих в ее состав атомов.
Основные характеристики молекулярной решетки
Молекулярная кристаллическая решетка является наименее устойчивой из всех представленных. Все дело в том, что уровень взаимодействия находящихся в ее узлах молекул крайне низкий, а энергетический потенциал определяется целым рядом факторов, основную роль в которых играют дисперсионные, индукционные и ориентационные силы.
Влияние кристаллической решетки на свойства объектов
Таким образом, кристаллическая решетка во многом определяет свойства того или иного вещества. Например, атомные кристаллы плавятся при чрезвычайно высокой температуре и обладают повышенной твердостью, а вещества с металлической решеткой являются прекрасными проводниками