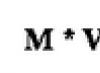Плотность - 0,902 г/см³. Температура плавления -83° C, температура кипения 77° C.
Этилацетат получают промышленным способом методом перегонки смеси этилового спирта, уксусной и серной кислот, а также методом обработки этилового спирта кетеном, или по реакции Тищенко из ацетальдегида при 0-5° C в присутствии каталитических количеств алкоголята алюминия.
Химическая формула: C 4 H 8 O 2 .
Применение этилацетата.
Как растворитель, являясь активным растворителем нитро- и этилцеллюлозы, широко используется в производстве лакокрасочных материалов и чернил для печатающих машин. Также он входит в композиции растворителей нитроглифталевих, перхлорвиниловых и эпоксидних эмалей, разных смазочных масел, восков, полиэфирных лаков, красок, кремниорганических лаков и эмалей. На эти цели расходуется до 30% всего производимого этилацетата;
Как растворитель в изготовлении клеевых композиций;
На стадии упаковывания различных товаров гибкими упаковочными материалами - как растворитель пленок и чернил при нанесении надписей и изображений трафаретным способом;
Как реагент и как реакционная среда в производстве фармацевтических препаратов (метоксазол, гидрокортизон, рифампицин и т.д.);
Как обезжиривающий агент в производстве алюминиевой фольги и тонких алюминиевых листов;
Как очищающий и обезжиривающий агент в электронной промышленности;
В производстве кино- и фотопленки, целлофана, различных резино-технических изделий;
В смеси со спиртом как растворитель в производстве искусственной кожи;
Как экстрагирующий агент для различных органических веществ из водных растворов. Благодаря низкой токсичности этилацетат используется в пищевой промышленности, например, для экстрагирования кофеина из кофе;
Как желатинизирующее средство при изготовлении взрывчатых веществ;
Как компонент (пищевая добавка E1504) фруктовой эссенции, которую добавляют в прохладительные напитки, ликеры и кондитерские изделия.
| Наименование показателя | Норма для марки и сорта | ||
| Марка А | Марка Б | ||
| Высший сорт | Первый сорт | ||
| Внешний вид | Прозрачная жидкость без механических примесей | ||
| Цветность по платиново-кобальтовой шкале, ед. Хазена, не более | 5 | 10 | 10 |
| Плотность при 20° С, г/см³ | 0,898-0,900 | 0,897-0,900 | 0,890-0,900 |
| Массовая доля этилацетата, % | не менее 99,0 | не менее 98,0 | 91,0±1 |
| Массовая доля кислот в пересчете на уксусную кислоту, %, не более | 0,004 | 0,008 | 0,010 |
| Массовая доля нелетучего остатка, %, не более | 0,001 | 0,003 | 0,007 |
| Температурные пределы перегонки при давлении 101,3 кПа (760 мм рт.ст.): 95% (по объему) продукта должно отгоняться в пределах температур, ° С |
75-78 |
74-79 |
70-80 |
| Массовая доля воды, %, не более | 0,1 | 0,2 | 1,0 |
| Массовая доля альдегидов в пересчете на уксусный альдегид, %, не более | 0,05 | не нормируется | - |
| Относительная летучесть (по этиловому эфиру) | 2-3 | 2-3 | 2-3 |
Требования безопасности.
Этилацетат технический по степени воздействия на организм человека относится к числу малоопасных веществ (4 класс опасности). Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей. При действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м⊃3.
Этилацетат технический является легковоспламеняющейся жидкостью и образует в смеси с воздухом взрывоопасную смесь категории ПА, группы Т2 по ГОСТ 12.1.011.
Органическая химия зародилась как химия природных соединений, выделенных из организмов животного и растительного происхождения. Заполнение различных классов веществ природными соединениями носит случайный характер и определяется биосинтезом (Карцова А. А. , 2005).
Первая задача органического синтеза – искусственное получение полезных веществ путем копирования природных структур. Этому предшествует стадия выделения природного соединения, изучение его свойств и, наконец, сам органический синтез - воспроизведение в исследовательской лаборатории того, что создано в лаборатории природы. Ну, а затем надо пойти дальше – синтезировать то, что в природе отсутствует.
Ежедневно в мире синтезируется 100 тыс. новых химических соединений, 97 % из которых приходится на долю органических веществ.
Я же решила рассмотреть синтез этилацетата по реакции этерификации.
Этилацетат – это уксусноэтиловый эфир, который находит широкое применение в медицине и ветенарии, в полиграфической промышленности; в качестве растворителя для придания необходимой консистенции краске, отвердителя для закрепления краски, мебельного лака. А также применяется как экстрагент органических соединений из водных растворов, желатинизирующее средство в производстве взрывчатых веществ; входит в состав промышленного термасвариваемого клея. Мировой объем производства этилацетата 0,45-0,5 млн. т в год (1986) (Рид Р. и др. , 1982)
Одним из способов в промышленности этилацетата является этерификация уксусной кислоты этанолом при 110-115° С в присутствии серной кислоты.
Поэтому цель моей работы было проведение синтеза этилацетата по реакции этерификации и изучение его свойства.
Хлористый кальций
Синтез осуществляют в приборе, изображенном на рисунке. В колбу Вюрца емкостью 100мл, снабженную капельной воронкой и соединительную с нисходящим холодильником, вливают 2,5 мл этилового спирта и затем осторожно при перемешивании приливают 1,5 мл концентрированной серной кислоты. Колбу закрывают пробкой, в которую вставлена капельная воронка. И нагревают на масляной (или металлической) бане до 140° С (термометр погружен в баню). В колбу из капельной воронки постепенно приливают смесь из 2 мл этилового спирта и 4,5 мл ледяной уксусной кислоты. Приливание следует вести с такой же скоростью, с какой отгоняется образующий эфир. По окончании реакции (после прекращения отгона эфира) погон переносят в делительную воронку и взбалтывают с концентрированным раствором соды для удаления уксусной кислоты. Отделяют верхний эфирный слой и встряхивают его с насыщенным раствором хлористого кальция (для удаления спирта, который дает с хлористым кальцием кристаллическое молекулярное соединение СаCl2 * C2H5OH, нерастворимое в уксусноэтиловом эфире). Отделив эфир, сушат его прокаленным хлористым кальцием и перегоняют на водяной бане из колбы с дефлегматором. При температуре 71-75° С будет отгоняться смесь спирта и этилацетата, при 75-78° С переходит практически чистый уксусноэтиловый эфир. Выход составляет 20 г (65 % теоретического) (Голодников Г. В. , Мандельштам, 1976).
Результаты
1. Механизм реакции.
В основе получения этилацетата лежит реакция этерификации, в результате которой сложный эфир образуется при нагревании до 140-150 0С уксусной кислоты с этиловым спиртом в присутствии катализатора – серной кислоты.
Общее уравнение реакции
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион:
Катион в результате отщепления протона образует молекулу сложного эфира;
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта – связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорании (СО2 и Н2О) на присутствие тяжелого изотопа кислорода (Тюкавкина Н. А. , Бауков Ю. И. , 2004).
Реакция этерификации – обратимый процесс, поэтому во избежание гидролиза полученного продукта, эфир отгоняли с использованием прямого холодильника.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их преобразования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесс, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2. Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
При проведении синтеза возможно установление химического равновесия. Согласно принципу Ле-Шателье, чтобы сместить равновесие в сторону образования продукта реакции приливание смеси этилового спирта и ледяной уксусной кислоты проводили с такой же скоростью, с какой отгонялся образующий эфир. Температура синтеза не превышала 150 0С.
При повышении температуры выше указанного значения возможно протекание реакции внутримолекулярной дегидратации:
В результате эксперимента была получена бесцветная с жидкость с характерным запахом. После прекращения выделения эфира полученный продукт переносили в делительную воронку и взбалтывали с концентрированным раствором соды для удаления уксусной кислоты.
Для удаления спирта верхний эфирный слой отделяли и встряхивали его с насыщенным раствором хлористого кальция. Этиловый спирт дает с хлористым кальцием кристаллическое молекулярное соединение состава СаCl2*C2H5OH, нерастворимое в уксусноэтиловом эфире. Отделив эфир, сушили его прокаленным хлористым кальцием.
2. Результаты исследования.
Был рассчитан выход (%) этилацетата в реакции. Согласно закону сохранения массы и энергии теоретический выход эфира составляет 6,3 г (7,0 мл). В результате синтеза было получено 4,5 мл (4,05 г) этилацетата. Выход продукта реакции (этилового эфира уксусной кислоты) равен 64,29 %.
Для идентификации и определения чистоты полученного этилацетата определили угол преломления с помощью рефрактометра. Согласно литературным данным чистый уксусноэтиловый эфир имеет угол преломления, равный 1, 3722. (Рид Р. и др. , 1982). В нашем случае угол преломления этилацетата составил 1,3718 . Данное значение близко к справочным данным, что свидетельствует о достаточной степени чистоты полученного продукта.
Этилацетат (этиловый эфир уксусной кислоты) 88 0,9 1,3722 1,3718 64,29
В результате проведенного синтеза (этерификации уксусной кислоты этиловым спиртом в присутствии серной кислоты при температуре 140 – 150 0С) был получен сложный эфир – этилацетат, который представлял собой прозрачную жидкость с характерным запахом. Для идентификации продукта измерили угол преломления этилацетата (1,3718), который близок к справочным данным. Выход этилового эфира уксусной кислоты составил 64,29%.
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном .
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n 20 4 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).
Применение
Этилацетат широко используется как растворитель , из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом - растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450-500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн. тонн в год.
Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 .
Лабораторное применение
Этилацетат часто используется для экстракции , а также для колоночной и тонкослойной хроматографии . Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира :
Очистка и сушка
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-го карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
Температура вспышки - 2 °C, температура самовоспламенения - 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1253.
Напишите отзыв о статье "Этилацетат"
Примечания
Отрывок, характеризующий Этилацетат
– Наверное? – сказала она.Лицо княгини изменилось. Она вздохнула.
– Да, наверное, – сказала она. – Ах! Это очень страшно…
Губка Лизы опустилась. Она приблизила свое лицо к лицу золовки и опять неожиданно заплакала.
– Ей надо отдохнуть, – сказал князь Андрей, морщась. – Не правда ли, Лиза? Сведи ее к себе, а я пойду к батюшке. Что он, всё то же?
– То же, то же самое; не знаю, как на твои глаза, – отвечала радостно княжна.
– И те же часы, и по аллеям прогулки? Станок? – спрашивал князь Андрей с чуть заметною улыбкой, показывавшею, что несмотря на всю свою любовь и уважение к отцу, он понимал его слабости.
– Те же часы и станок, еще математика и мои уроки геометрии, – радостно отвечала княжна Марья, как будто ее уроки из геометрии были одним из самых радостных впечатлений ее жизни.
Когда прошли те двадцать минут, которые нужны были для срока вставанья старого князя, Тихон пришел звать молодого князя к отцу. Старик сделал исключение в своем образе жизни в честь приезда сына: он велел впустить его в свою половину во время одевания перед обедом. Князь ходил по старинному, в кафтане и пудре. И в то время как князь Андрей (не с тем брюзгливым выражением лица и манерами, которые он напускал на себя в гостиных, а с тем оживленным лицом, которое у него было, когда он разговаривал с Пьером) входил к отцу, старик сидел в уборной на широком, сафьяном обитом, кресле, в пудроманте, предоставляя свою голову рукам Тихона.
– А! Воин! Бонапарта завоевать хочешь? – сказал старик и тряхнул напудренною головой, сколько позволяла это заплетаемая коса, находившаяся в руках Тихона. – Примись хоть ты за него хорошенько, а то он эдак скоро и нас своими подданными запишет. – Здорово! – И он выставил свою щеку.
Старик находился в хорошем расположении духа после дообеденного сна. (Он говорил, что после обеда серебряный сон, а до обеда золотой.) Он радостно из под своих густых нависших бровей косился на сына. Князь Андрей подошел и поцеловал отца в указанное им место. Он не отвечал на любимую тему разговора отца – подтруниванье над теперешними военными людьми, а особенно над Бонапартом.
– Да, приехал к вам, батюшка, и с беременною женой, – сказал князь Андрей, следя оживленными и почтительными глазами за движением каждой черты отцовского лица. – Как здоровье ваше?
– Нездоровы, брат, бывают только дураки да развратники, а ты меня знаешь: с утра до вечера занят, воздержен, ну и здоров.
– Слава Богу, – сказал сын, улыбаясь.
– Бог тут не при чем. Ну, рассказывай, – продолжал он, возвращаясь к своему любимому коньку, – как вас немцы с Бонапартом сражаться по вашей новой науке, стратегией называемой, научили.
Князь Андрей улыбнулся.
– Дайте опомниться, батюшка, – сказал он с улыбкою, показывавшею, что слабости отца не мешают ему уважать и любить его. – Ведь я еще и не разместился.
– Врешь, врешь, – закричал старик, встряхивая косичкою, чтобы попробовать, крепко ли она была заплетена, и хватая сына за руку. – Дом для твоей жены готов. Княжна Марья сведет ее и покажет и с три короба наболтает. Это их бабье дело. Я ей рад. Сиди, рассказывай. Михельсона армию я понимаю, Толстого тоже… высадка единовременная… Южная армия что будет делать? Пруссия, нейтралитет… это я знаю. Австрия что? – говорил он, встав с кресла и ходя по комнате с бегавшим и подававшим части одежды Тихоном. – Швеция что? Как Померанию перейдут?
Князь Андрей, видя настоятельность требования отца, сначала неохотно, но потом все более и более оживляясь и невольно, посреди рассказа, по привычке, перейдя с русского на французский язык, начал излагать операционный план предполагаемой кампании. Он рассказал, как девяностотысячная армия должна была угрожать Пруссии, чтобы вывести ее из нейтралитета и втянуть в войну, как часть этих войск должна была в Штральзунде соединиться с шведскими войсками, как двести двадцать тысяч австрийцев, в соединении со ста тысячами русских, должны были действовать в Италии и на Рейне, и как пятьдесят тысяч русских и пятьдесят тысяч англичан высадятся в Неаполе, и как в итоге пятисоттысячная армия должна была с разных сторон сделать нападение на французов. Старый князь не выказал ни малейшего интереса при рассказе, как будто не слушал, и, продолжая на ходу одеваться, три раза неожиданно перервал его. Один раз он остановил его и закричал:
– Белый! белый!
Это значило, что Тихон подавал ему не тот жилет, который он хотел. Другой раз он остановился, спросил:
– И скоро она родит? – и, с упреком покачав головой, сказал: – Нехорошо! Продолжай, продолжай.
В третий раз, когда князь Андрей оканчивал описание, старик запел фальшивым и старческим голосом: «Malbroug s"en va t en guerre. Dieu sait guand reviendra». [Мальбрук в поход собрался. Бог знает вернется когда.]
Сын только улыбнулся.
– Я не говорю, чтоб это был план, который я одобряю, – сказал сын, – я вам только рассказал, что есть. Наполеон уже составил свой план не хуже этого.
– это этиловый этер этановой кислоты в виде горючего не имеющего цвета летучего жидкого вещества, обладающего резким запахом фруктов. Механические примеси отсутствуют. Это в меру полярный растворяющий продукт со свойствами эстеров. Растворению поддается в метилкарбиноле, этиловом эфире, бензоле , метилтрихлориде, метилбензоле и некоторых иных органических растворителях. Что касается воды, то в ней растворение более слабое. Сам же растворяюще действует на эфиры целлюлозы, смоляные лаки на масляной основе, жиры и воски.
Молярная масса – 88,11 г/моль, плотность – 0,902 г/см³. Термосвойства: t плавления – -83 °C, t кипения – 77 °C. Формула: C 4 H 8 O 2 .
Получение в пром. масштабах происходит в ходе реакции этанола и уксусной кислоты . Также возможна обработка этанола с помощью карбометилена или синтез из уксусного альдегида при наличии катализатора алкоксида алюминия.
Применение этилацетата
Главная роль данного вещества – растворяющая (на это уходит треть всего выпускаемого этилового эфира этановой кислоты). Ему отдают предпочтение среди других растворителей, ввиду невысокой цены, малотоксичности и вполне сносного запаха. С его помощью растворяют нитро- и ацетилцеллюлозу, воски и жиры, нитроглифталевые, перхлорвиниловые, эпоксидные, полиэфирные, кремнийорганические лаки, краски, эмали, а также очищают печатные платы. Так, он задействуется в изготовлении ЛК материалов, клеевых композиций и чернил для печатной техники. При упаковке товара с помощью всяческих гибких паковальных материалов берется для растворения в ходе трафаретного нанесения надписей и рисунков. В совокупности со спиртом этилацетат как растворитель используют, кроме всего прочего, при изготовлении искусственной кожи.
Это, к тому же, популярнейший ядохимикат. Он входит в состав энтомологических морилок (задача – умерщвлять насекомых). Если сравнивать с тем же хлороформом , который применяется с аналогичной целью, этилацетат более размягчает объект воздействия и делает его податливее в препарировании.
Используется данное вещество ввиду низкотоксичности и в качестве составляющей фруктовых эссенций. Это известная добавка к пище E1504. Ее вносят в охлаждающие напитки, ликеры и различную кондитерку. С ее помощью из кофе экстрагируют кофеин.
В лабораторной практике находит применение в экстракции для вытягивания орган. веществ из водных растворов и хроматографии (колоночной и тонкослойной). Иногда выступает растворителем в некоторых хим. реакциях. Редкость такого использования объясняется склонностью к сольволизу водой и переэтерефикации.
Фармацевты применяют его как реакционную среду для изготовления ряда препаратов: метоксазола, гидрокортизона, рифампицин и др.
Этилацетат – это участник процесса синтеза этилового эфира ацетоуксусной кислоты.
При создании взрывчатки выступает желатинизатором. В электронной отрасли, при создании алюминиевой фольги и тонких листков алюминия – очистителем и обеззараживателем. Задействуется и в создании фото-, кинопленок, целлофана, всяческих тех. изделий из резины .
Этилацетат в промышленности
Этилацетат , или эфир этановой кислоты, находит широкое применение в разных пром. отраслях, выполняя большой перечень задач:
– в лакокрасочном, клеевом, целлюлозном производстве и изготовлении искусственной кожи, чернил для печатных машинок выступает растворителем. Также растворяющее действует при нанесении чернильных рисунков и надписей на упаковочные материалы;
– в фармацевтической отрасли служит реагентом и реакционной средой при изготовлении лекарств;
– в создании алюминиевой фольги и тонких листов алюминия – обезжиривателем;
– в электронной промышленности также используется для обезжиривания, а еще для очищения;
– в пищепроме это популярный экстрагент (к примеру, помогает экстрагировать кофеин из кофе). Кроме того, его задействуют при создании охлаждающих напитков, ликеров, кондитерки и фруктовых эссенций;
– в производстве взрывчатки – желатинизатор;
– в косметической промышленности его вводят в состав средств для маникюра, в частности для снятия лакового покрытия с ногтей.
Такая широта применения обусловлена относительной недороговизной, низкотоксичностью и эффективностью в каждом из вышеперечисленных процессов.
Благодаря высокой эффективности и функционализму, с учетом незначительной токсичности, этилацетат и получил столь широкое применение.